Роль коррекции дисбаланса макроэлементов в повышении эффективности лечения больных гипертонической болезнью
Ю. А. Сычева, Кафедра внутренних болезней стоматологического факультета Санкт-Петербургского государственного медицинского университета имени академика И. П. Павлова

Гипертоническая болезнь (ГБ) остается одним из наиболее распространенных заболеваний сердечно-сосудистой системы и является фактором риска других сердечно-сосудистых патологий. В изучении механизмов патогенеза данного заболевания отмечается повышенное внимание к оценке роли электролитных расстройств. Особенно актуально изучение дисбаланса макроэлементов (избытка натрия и кальция, дефицита калия и магния) [5, 6, 8]. Полагают, что наследственный фактор в развитии гипертонической болезни реализует себя через генетически детерминированные дефекты трансмембранного переноса ионов, которые определяют рост содержания ионизированного кальция в цитозоле миоцитов стенки резистивных сосудов [7]. Нарушения трансмембранного переноса ионов ведут к задержке во внутренней среде натрия, росту преднагрузки сердца за счет увеличения сердечного выброса и устойчивому усиленному спазму периферических сосудов, что формирует механизмы ГБ. Оба эти процесса являются Са2+-зависимыми сила сокращения сердца регулируется увеличением цитоплазматической концентрации Са2+ в кардиомиоцитах, а расслабление сосудов удалением Са2+ из цитоплазмы клеток [2]. Повышенное содержание внутриклеточного кальция обуславливает склонность к генерализованной вазоконстрикции. Рост содержания свободного кальция в гладкомышечных элементах сосудистой стенки повышает степень сокращения и сократительную способность миоцитов стенки сосудов, что связывают с изменениями активности переноса кальция через наружную и другие клеточные мембраны посредством функционирования Са2+-АТФазы. Данная ионная помпа, которая выводит ионизированный кальций в межклеточные пространства, представляет собой связанную с кальмодулином Са+-АТФазу. Магний, являясь естественным антагонистом кальция, участвует в процессах мембранного транспорта, способствует торможению сократительной активности гладких и поперечно-полосатых мышц за счет расслабления отдельных клеток (миоцитов) путем блокады кальцийзависимого взаимодействия сократительных белков. Среди всех катионов магний занимает 4-е место по содержанию в организме человека после К+, Na+, Ca2+ и 2-е место после К+ по содержанию в клетке [4]. Магний универсальный регулятор биохимических и физиологических процессов в организме обеспечивает гидролиз АТФ, уменьшая разобщение окисления и фосфолирования, регулирует гликолиз, уменьшает накопление лактата, способствует фиксации калия в клетках, обеспечивая поляризацию клеточных мембран, контролирует спонтантную электрическую активность нервной ткани и проводящей системы сердца, контролирует нормальное функционирование кардиомиоцитов на всех уровнях субклеточных структур, в связи с чем является универсальным кардиопротектором [9]. Адекватный магниевый обмен нормализует деятельность мышцы сердца и его кровоснабжение, управляет процессами возбудимости и проводимости нервных элементов (нервная ткань, проводящая система сердца). Все энергетические процессы в организме проходят при обязательном участии магния [1113]. Существует наблюдение, что он обладает сосудорасширяющим действием, способствует выведению холестерина, снижает свертываемость крови [3]. Магний участвует в функционировании антиоксидантной системы, при недостатке магния развивается первичное нарушение окислительно-восстановительных процессов в организме, что приводит к метаболическим сдвигам [1, 9, 10].
Таким образом, выявление самого факта артериальной гипертензии уже подтверждает имеющийся тканевой или сывороточный дефицит магния и является
показанием для дополнительного введения данного макроэлемента [8]. Кроме того, традиционное лечение ГБ может приводить к усугублению дефицита магния: длительное применение антагонистов кальция способно снижать эритроцитарное и сывороточное содержание магния, применение диуретиков также приводит к гипомагниемии (в первую очередь, речь идет о тиазидовых и тиазидоподобных препаратах (гидрохлортиазид, в меньшей степени индапамид)) [8].
Цель исследования: повышение эффективности традиционной антигипертензивной терапии путем коррекции дисбаланса макроэлементов у больных ГБ.
Задачи исследования:
1) оценить особенность распределения патогенетически значимых макроэлементов Са, Na, Mg, K во вне- и внутриклеточных средах (на модели «плазма эритроциты крови») в сопоставлении с активностью свободно-радикального окисления;
2) сопоставить степень корригируемости АД с особенностями дисбаланса макроэлементов;
3) оценить динамику эффективности традиционной
антигипертензивной терапии на фоне коррекции дисбаланса распределения макроэлементов в биологических средах.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Критерии включения пациентов в исследование:
1) возраст старше 18 лет;
2) гипертоническая болезнь II степени.
Критерии исключения из исследования:
1) инфаркт миокарда в течение последних шести месяцев, нестабильная стенокардия, чрезкожные коронарные вмешательства, острое нарушение мозгового кровообращения, преходящее нарушение мозгового кровообращения;
2) вторичная гипертензия любой этиологии;
3) АВ-блокада 2-й и 3-й степени, фибрилляция предсердий и другие виды аритмий, требующие лечения;
4) ХСН I II и IV ф. к. по NYHA;
5) почечная недостаточность, нефрэктомия, стеноз обеих почечных артерий;
6) декомпенсированный сахарный диабет.
После подписания информированного согласия в исследование были включены 35 больных, из них 15 мужчин, 20 женщин, в возрасте от 45 до 65 лет (в среднем 55±10 лет). У всех пациентов была диагностирована ГБ II стадии. Больные получали антагонисты кальция и мочегонные. При обследовании всем больным проводилось повторное измерение артериального давления, исследование состояния глазного дна, ЭКГ, эхокардиография, клинические анализы крови и мочи, изучение показателей липидного спектра крови. Содержание макроэлементов (Ca, Mg, K, Na) в циркулирующей плазме крови и в эритроцитах оценивали методом атомноабсорбционной спектрометрии на аппарате ААС-1 (Германия).
Оценку активности свободнорадикального окисления белков осуществляли по тиолдисульфидному соотношению методом амперометрического титрования
по В. В. Соколовскому.


РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
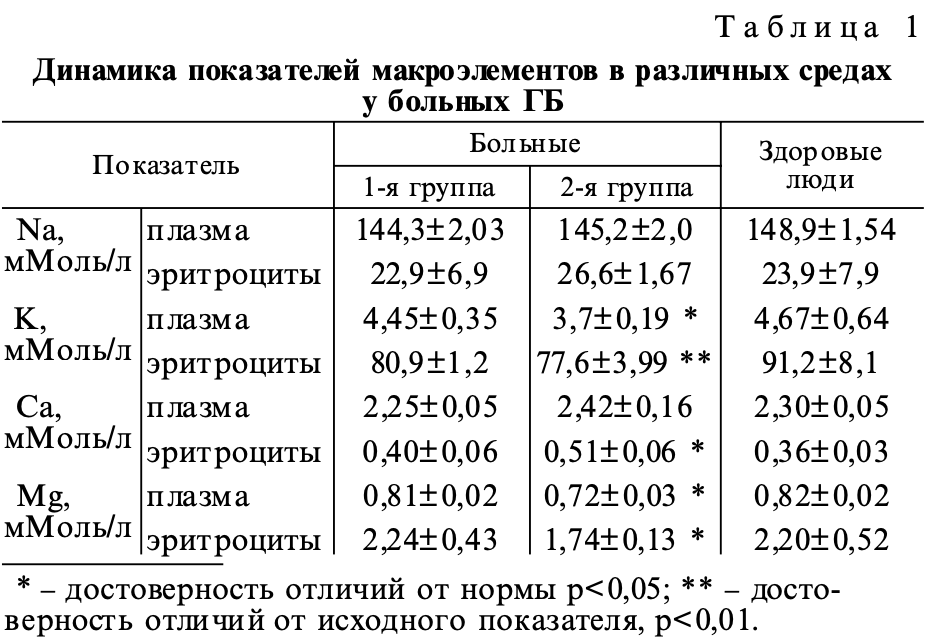
У 20 больных с ГБ на фоне приема антигипертензивных препаратов была отмечена высокая клиническая эффективность и АД достигло целевых цифр, эти больные составили первую группу наблюдения. Вторую группу составили 10 (28,5 %) больных ГБ, у которых цифры АД на фоне лечения снизились, однако окончательная стабилизация АД не наступила, у этих больных сохранялись жалобы на периодические головные боли и головокружение. У больных II группы ГБ без стабилизации АД на фоне приема антагонистов кальция и мочегонных распределение макроэлементов в различных средах характеризовалось накоплением внутриклеточного присутствия Na и Са при достоверном дефиците K и Mg. В то время как в 1-й группе со стабильным АД отмечалась стабильность равновесия в обмене макроэлементов (табл. 1). В ходе исследования у больных установлено изменение показателей окисления тиолов. Признаками активности свободнорадикального окисления тиолов у больных I группы явились снижение показателей восстановленной серы в составе SH-групп белков, повышение окисленной серы в составе SS-групп белков, но достоверно изменились эти показатели во 2-й группе, в которой обнаружен дефицит Mg (табл. 2). Изменения в данной системе в виде снижения тиолдисульфидного отношения (ТДО = SH/SS) позволяют предположить у больных, страдающих ГБ, развитие окислительного стресса. Инициирование в организме процессов свободнорадикального окисления сопряжено с функциональной недостаточностью обеспечения антиоксидантной защиты. Макроэлемент Mg самостоятельно участвует во многих метаболических реакциях по образованию, накоплению, переносу и утилизации энергии, свободных радикалов и продуктов их окисления, в работе отмечено закономерное увеличение активности перекисного окисления белков на фоне дефицита Mg. Дефицит Mg, возможно, снижает клиническую эффективность антигипертензивной терапии антагонистами кальция, основной механизм действия которых заключается в том, что они тормозят проникновение ионов кальция из межклеточного пространства в мышечные клетки сердца и сосудов через медленные кальциевые каналы L-типа. Снижая концентрацию ионов Ca2+ в кардиомиоцитах и клетках гладкой мускулатуры сосудов, они расширяют коронарные артерии и периферические артерии и артериолы, оказывают выраженное сосудорасширяющее действие. При дефиците Mg нарушается освобождение внутриклеточных сред от излишков кальция, что закрепляется в условиях блокады кальциевых каналов, тормозящей процессы мембранного транспорта Ca. Это может снижать эффективность антигипертензивной терапии антагонистами кальция.
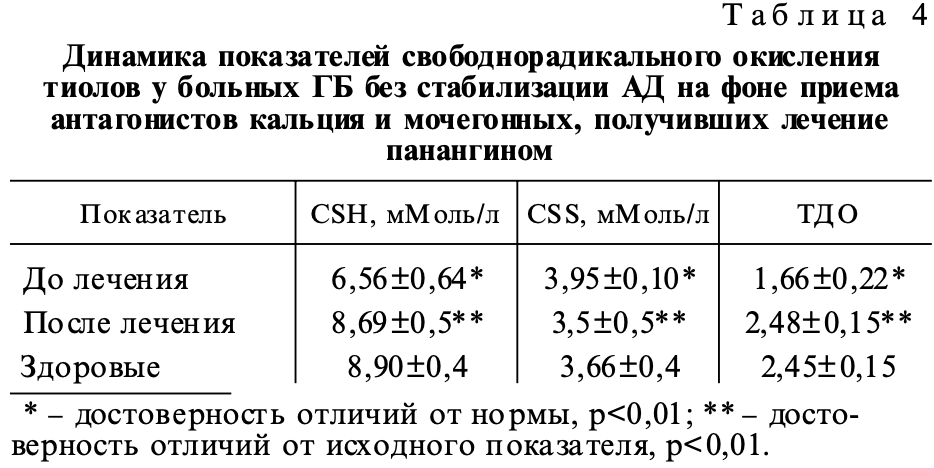
Установленные закономерности, выявляющие нарушения минерального баланса, послужили основанием для назначения больным 2-й группы с ГБ без стабилизации АД на фоне приема антагонистов кальция и мочегонных препаратов заместительной терапии с использованием панангина препарата, содержащего аспарагиновые соли магния и калия. Медикаментозную коррекцию дефицита магния больным проводили назначением панангина. Прием осуществлялся курсом по 1 драже панангина 3 раза в день 4 недели. Присоединение препаратов, содержащих магний, к стандартной антигипертензионной терапии антагонистами кальция и мочегонными усиливало эффективность лечения и приводило к отчетливому клиническому улучшению состояния больных на фоне и стабилизации АД. Отмечено достоверное снижение среднесуточных показателей САД и ДАД (с 165,51±7,75/102,82±4,47 мм рт. ст. до 123,57±8,85/75,45±6,28 мм рт. ст., р<0,01). Уменьшение головокружения отметили 5 человек (50 %), головной боли 8 человек (80 %). По истечении указанных сроков больные проходили контрольное обследование (табл. 3). Лечение панангином проводилось не только под контролем распределения макроэлементов (К, Na, Mg, Ca) в плазме крови и внутриклеточных средах, но и перекисного окисления белков. Назначение панангина и коррекция дефицита Mg оптимизировало антирадикальную защиту белков (табл. 4). При восполнении дефицита Mg не только уменьшалась интенсивность окисления белковой серы с образованием SS-групп, но и увеличивались ресурсы восстановленной серы, готовой к противоокислительной защите молекул белков.
ВЫВОДЫ
1. При обследовании больных с ГБ установлено, что дефицит Mg сопряжен с высокой активностью свободнорадикального окисления белков с истощением антиоксидантных ресурсов.
2. Больным с ГБ без нормализации АД на фоне приема антагонистов кальция и мочегонных необходимо проводить оценку содержания магния в плазме крови и в эритроцитах, дефицит макроэлемента снижает эффективность использования антагонистов кальция за счет транспортных нарушений кальция и магния.
3. Коррекция дефицита магния в условиях артериальной гипертензии способствует повышению эффективности терапии в комплексном лечении ГБ.
1. Акарачкова, Е. С. Применение Магне В6 в терапевтической практике / Е. С. Акарачкова // Трудный пациент. 2007. № 5. С. 4854.
2. Беликова, Н. А. Активность Са2+-АТФ-азы плазматических мембран лимфоцитов больных первичной артериальной гипертензией: автореф. дис. … канд. биол. наук / Н. А. Беликова. М., 2003. 147 с.
3. Буданова, М. В. Клинические проявления и эффекты коррекции дефицита магния у детей / М. В. Буданова, П. А. Асланова, П. В. Буданов // Трудный пациент. 2009. Т. 7. № 1 2. С. 5054.
4. Бурчинский, С. Г. Проблема дефицита магния в организме: методы фармакологической коррекции / С. Г. Бурчинский // Здоровье Украины. 2004. № 103. С. 56.
5. Горбачева, И. А. Роль дисбаланса макро- и микроэлементов в патогенезе заболеваний внутренних органов в сочетании с генерализованным пародонтитом / И. А. Горбачева, А. И. Кирсанов // Вестник Санкт-Петербург. гос. мед. академии им. И. И. Мечникова. 2003. № 1. С. 123126.
6. Кирсанов, А. И. Опыт совершенствования подготовки врачей интернов и клинических ординаторов на кафедре внутренних болезней стоматологического факультета / А. И. Кирсанов [и др.] // Материалы IV науч.-метод. конф. СПбГМУ им. акад. И. П. Павлова. «Современные проблемы последипломной подготовки врачей». СПб., 2001. С. 8790.
7. Постнов, Ю. В. О роли кальциевой перегрузки митохондрий и энергетического дефицита в патогенезе первичной артериальной гипертензии / Ю. В. Постнов // Архив патологии. 2001. № 3. С. 310.
8. Садовникова, И. И. Электролитный дисбаланс при сердечно-сосудистых заболеваниях коррекция необходима / И. И. Садовникова // Рус. мед. журн. 2007. Т. 15. № 9. С. 782784.
9. Шилов, А. М. Взаимосвязь дефицита магния и метаболи- ческий синдром / А. М. Шилов [и др.] // Рус. мед. журн. 2009. Т. 17. № 8. С. 576582.
10. Cernak, I. Alterations in magnesium and oxidative status during chronic emotional stress / I. Cernak [et al] // Magnes. Res. 2000. № 3. Р. 3445.
11. Iezhitsa, I. N. Potassium and magnesium depletions in congestive heart failurepathophysiology, consequences and replenishment / I. N. Iezhitsa // Clin. Calcium. 2005. Vol. 15. № 11. Р. 123133.
12. James, M. Serum Magnesium and Risk of Sudden Cardiac Death in the Atherosclerosis Risk in Communities (ARIC) Study / M. James [et al] // American Heart Journal. 2010. Vol. 160. № 3. Р. 464470.
13. Ueshima, K. Magnesium and ischemic heart disease: a review of epidemiological, experimental, and clinical evidences / K. Ueshima // Magnes. Res. 2005. Vol. 18. № 4. Р. 275284.